【2022年】大脳基底核の機能と障害は?MRI画像、大脳基底核ループから疾患、リハビリテーションまで
はじめに
大脳基底核とは、主に運動制御を司る脳内の皮質下核群のことで、運動学習、遂行機能、情動行動などの役割を担い、報酬と強化、習慣性行動、習慣形成に重要な役割を担っています。
大脳基底核は前脳(大脳)の基底部に位置し、病気や外傷による機能障害に伴って現れる様々な障害があり、医学的にも注目されています。
大脳基底核のネットワークは、パーキンソン病やハンチントン病などの運動障害の基盤となります。
20年以上前に提唱された古典的な大脳基底核モデルは、運動の適切な実行のために、情報が大脳基底核を通り、相反する効果を持つ2つの経路を通って大脳皮質に戻ることを示すものです。
このモデルの多くは現在も残っていますが、新しいデータの出現により、モデルは修正されています。
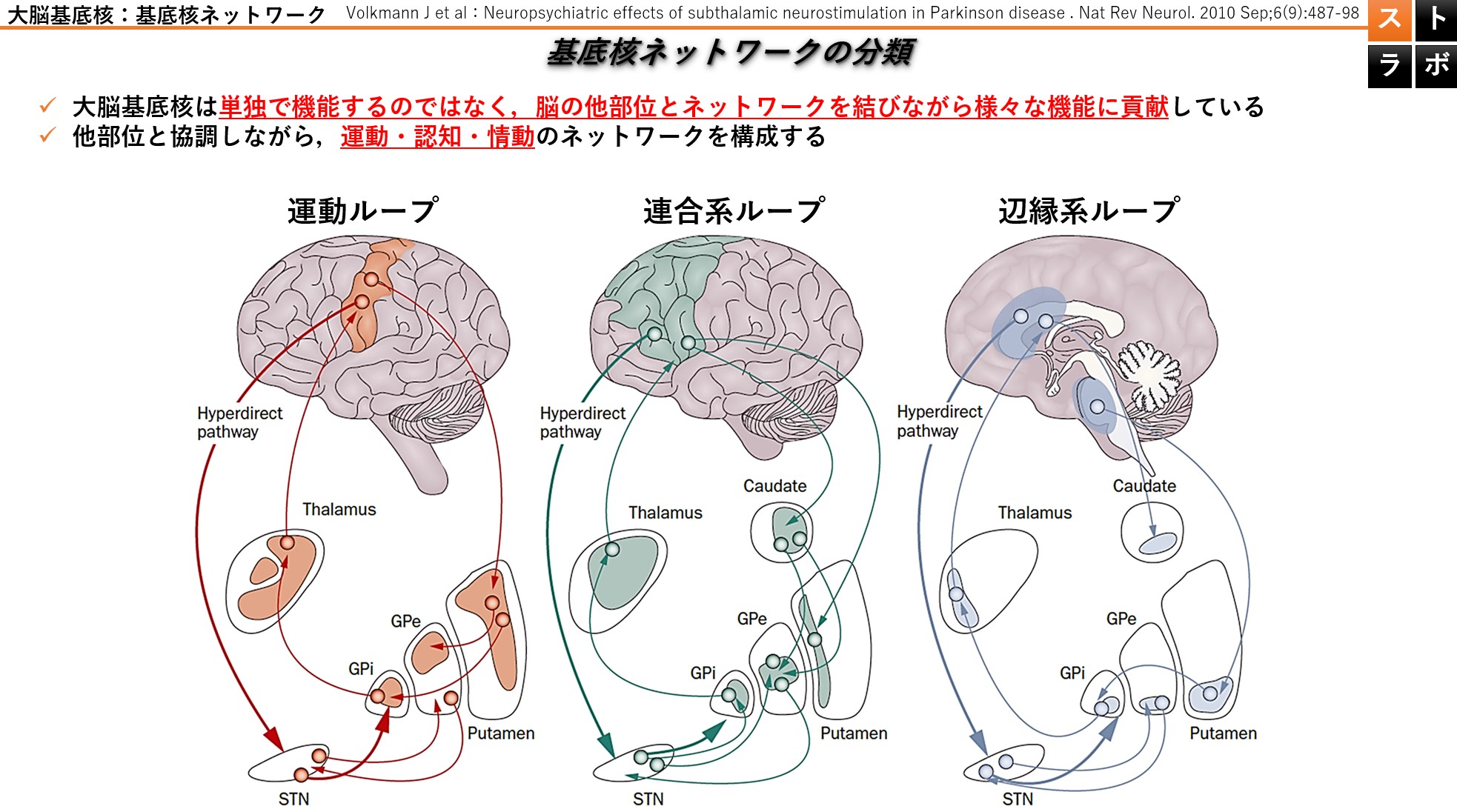
現在では、基底核ネットワークは複数の並列ループと再入力回路として捉えられ、運動領域、連合領域、辺縁系領域が主に運動、行動、感情の制御に関与しています。
これらの並列回路は、大脳基底核の他の機能である連合野と大脳辺縁系を補助しています。
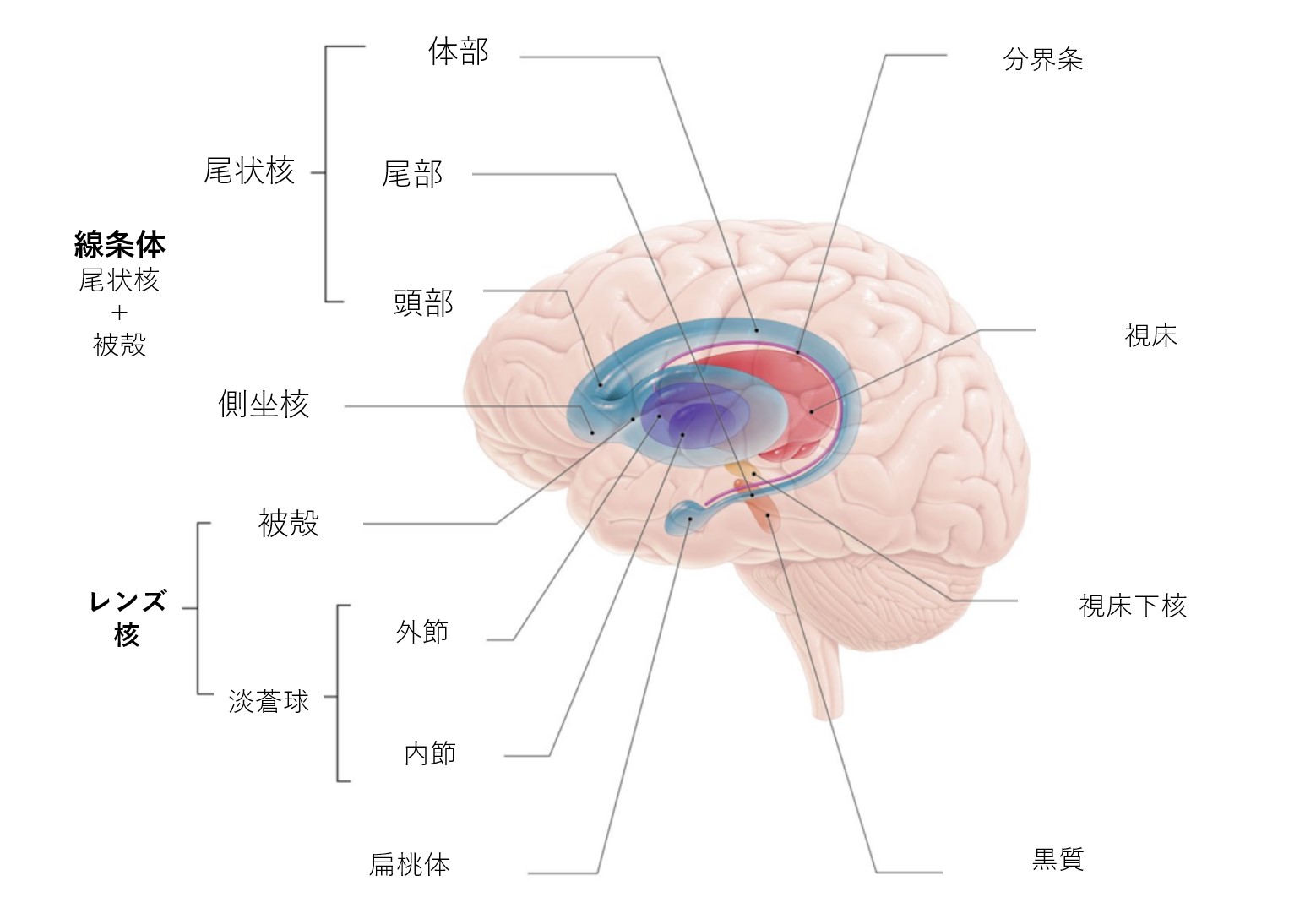
構造
大脳基底核は、大脳半球の深部にある皮質下の核の集まりです。基底核の最大の構成要素は、尾状核、レンズ核(被殻、淡蒼球)、視床下核(STN)、黒質核(SN)を含む線条体です。これらの構造は互いに複雑にシナプスし、運動を促進または抑制します。
大脳基底核の区分
線条体 (基底核の中で最大の皮質下脳構造は、体積が約10cmの線条体である)。線条体は、皮質および皮質下構造から求心性神経を受け、様々な基底核に投射する異質な構造です。
背側線条体(DS) は、主に意識的な運動と実行機能の制御に関与します。 背側線条体は尾状核と被殻から形成され、背側線条体の白質、神経路(内果)が尾状核と被殻を分けています
腹側線条体は報酬と嫌悪の大脳辺縁系機能を司り、側坐核と嗅覚結節から形成されます。
淡蒼球の内節および外節の区画(19世紀前半まで淡蒼球と被殻を1つの構造とみなし、まとめてレンズ核と呼ばれていました)。
視床下核(STN)-レンズ状の細胞群であり、視床下部の大部分を構成しています。
黒質(SN)-中脳にある長い核ですが、他の脳幹核と相互結合しているため、機能的には大脳基底核の一部と考えられています。
MRI画像
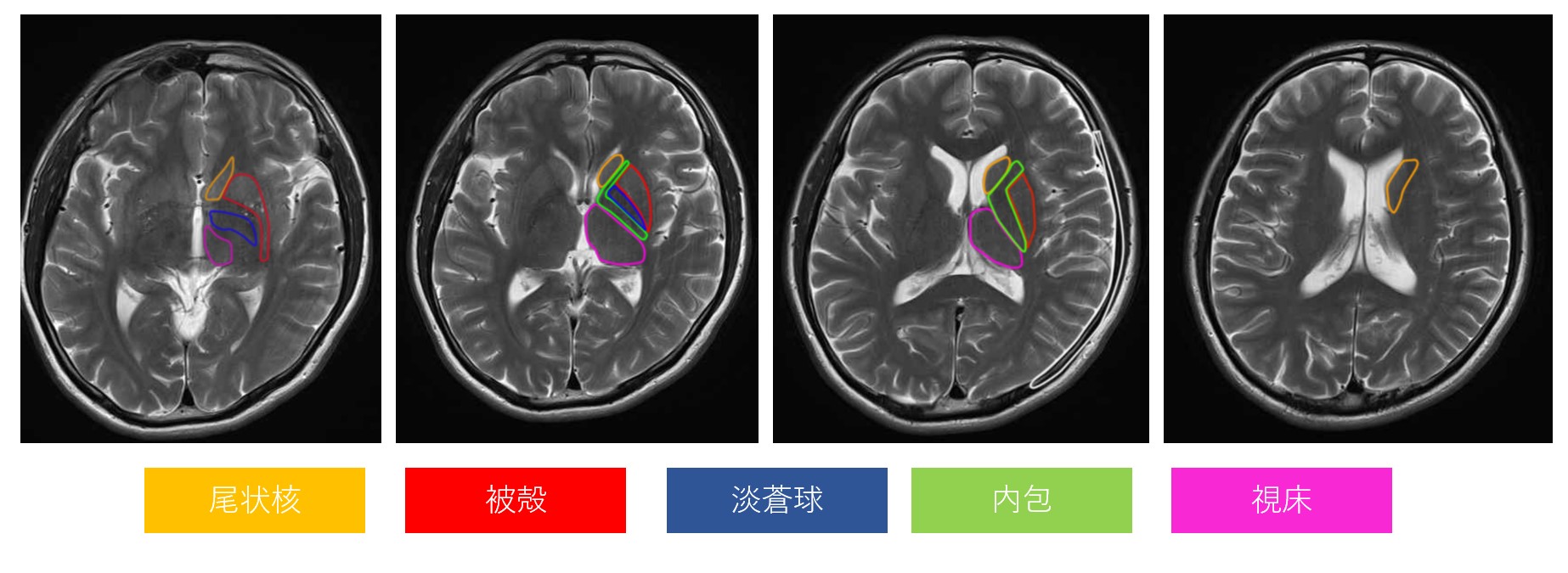
引用元:画像診断Cafe
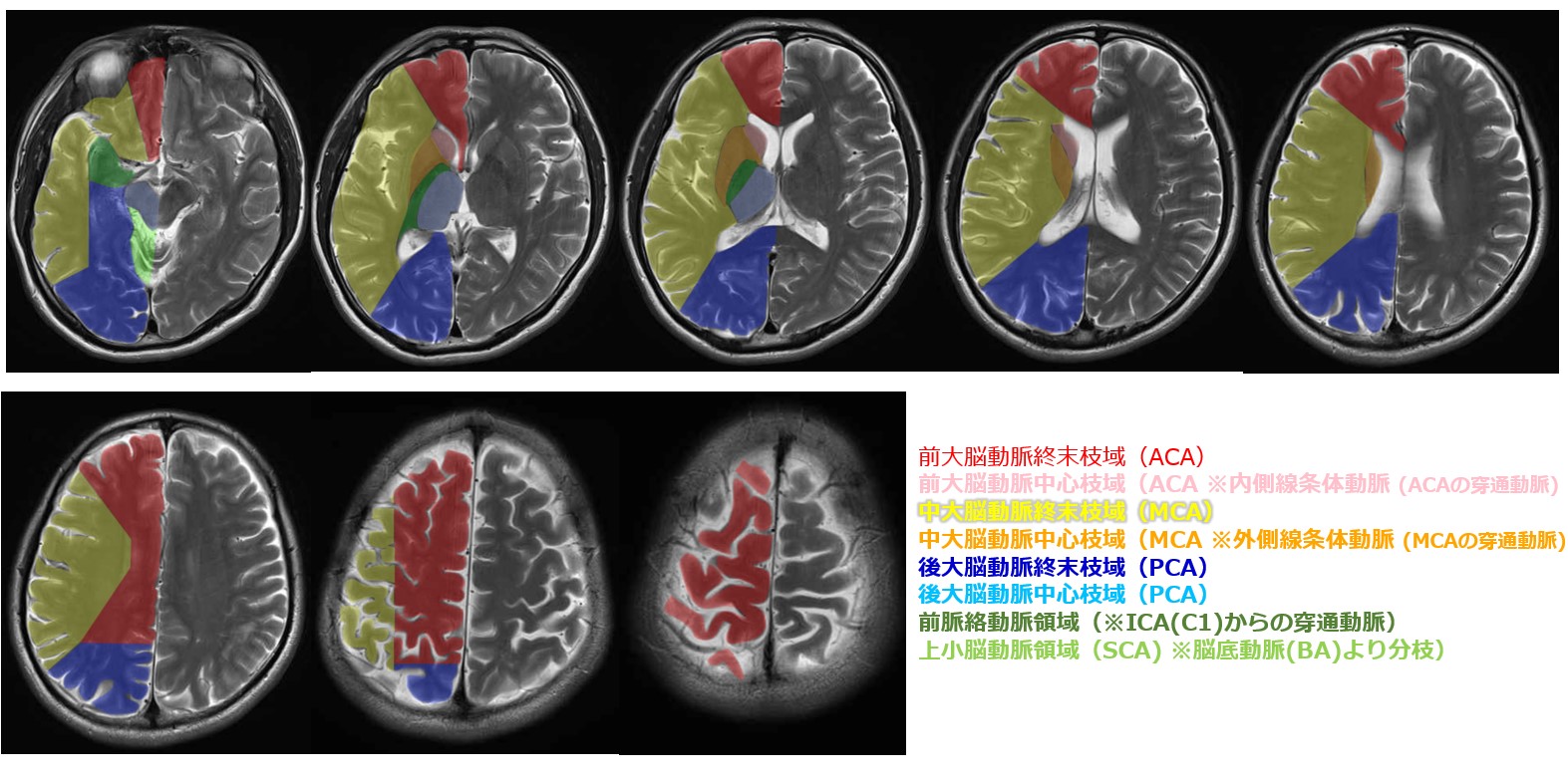
引用元:画像診断Cafe
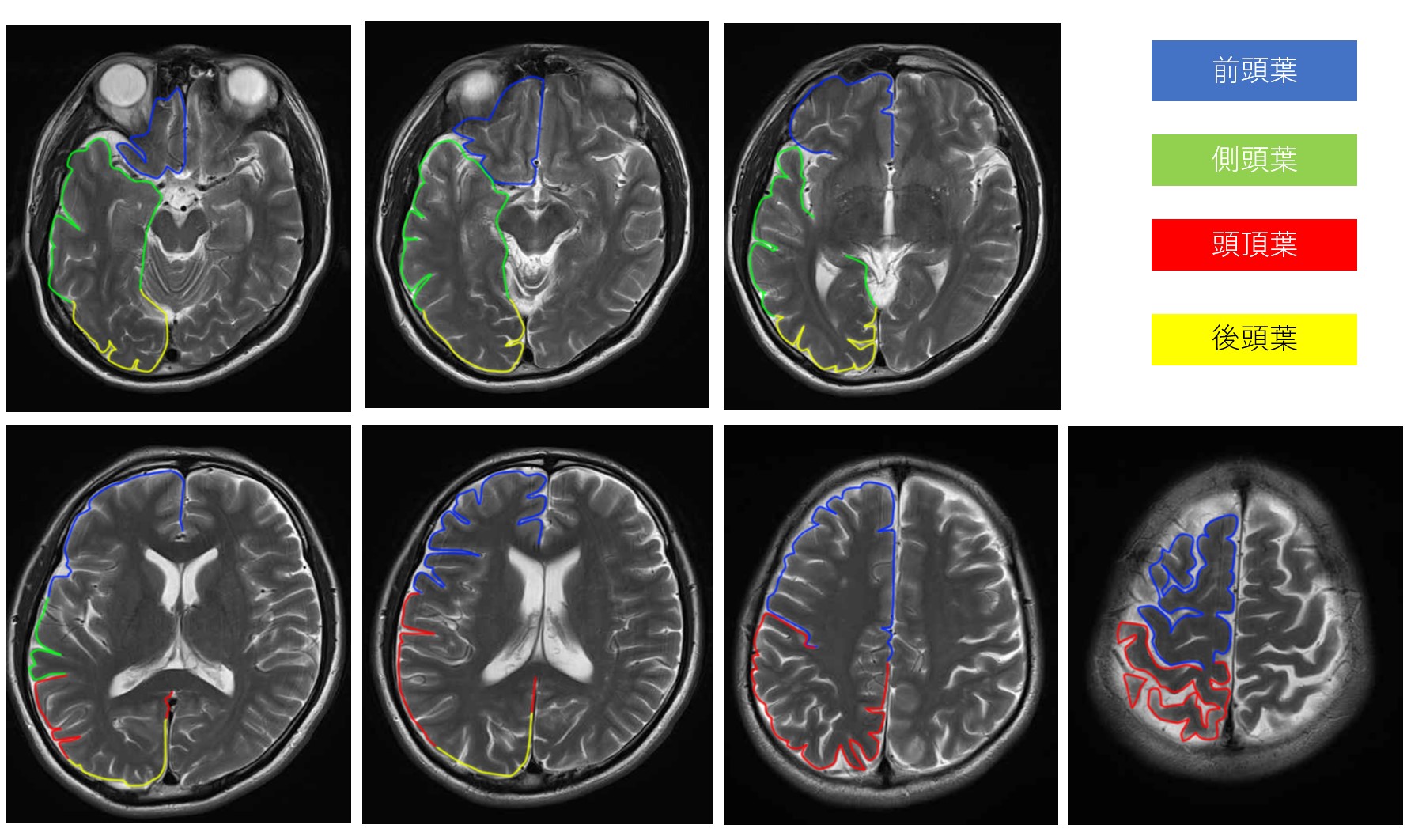
引用元:画像診断Cafe
現在の概念は?
大脳基底核の機能構成は、大脳皮質の求心性活動が基底核に伝達され、基底核によって調節された後、大脳皮質に信号を送り返し、運動活動を促進(または抑制)するというループとして考えられていました。
大脳基底核は、運動ループの中で「通過点」としての役割を担っていたのです。
現在では、大脳基底核には複数のループがあり、皮質および皮質下の突起が内部のループと相互作用して複雑なネットワークを形成し、同時に起こる事象や信号を選択したり抑制したりするために理想的に設計されていると考えられています。
大脳基底核外のネットワーク:①運動ループ
外ネットワークの一つである運動ループは、運動関連領域と被殻を結ぶループであり、主に運動機能に関与しています。主に被殻上部の神経細胞と連絡をとっています。障害を受けた場合の臨床症状としては,①無動や寡動②不随意運動が認められます。
大脳基底核外のネットワーク:②連合系ループ
背外側前頭前皮質ループと眼窩前頭皮質ループがあり、主に意思決定やワーキングメモリ・遂行機能に関与しています。主に被殻の内側付近の神経細胞と密に連絡をとっています。障害を受けた場合の臨床症状としては、①遂行機能障害②記憶障害が認められます。
大脳基底核外のネットワーク:③辺縁系ループ
大脳辺縁系とのループであり、意欲や情動行動のコントロールに関与しています。主に被殻下部の神経細胞と密に連絡をとっています。障害を受けた場合の臨床症状としては、もちろんのこと情動・感情の表出,意欲,意志の発動障害が認められる可能性があります。
近年の海外の研究によれば、大脳基底核にも皮質におけるホムンクルスと同様に、機能局在が存在するとの報告がされています。ただの被殻出血として見ずに、被殻のどの辺の病巣なのかを画像読影した上でセラピーしていくことの重要性を示唆してくれています。
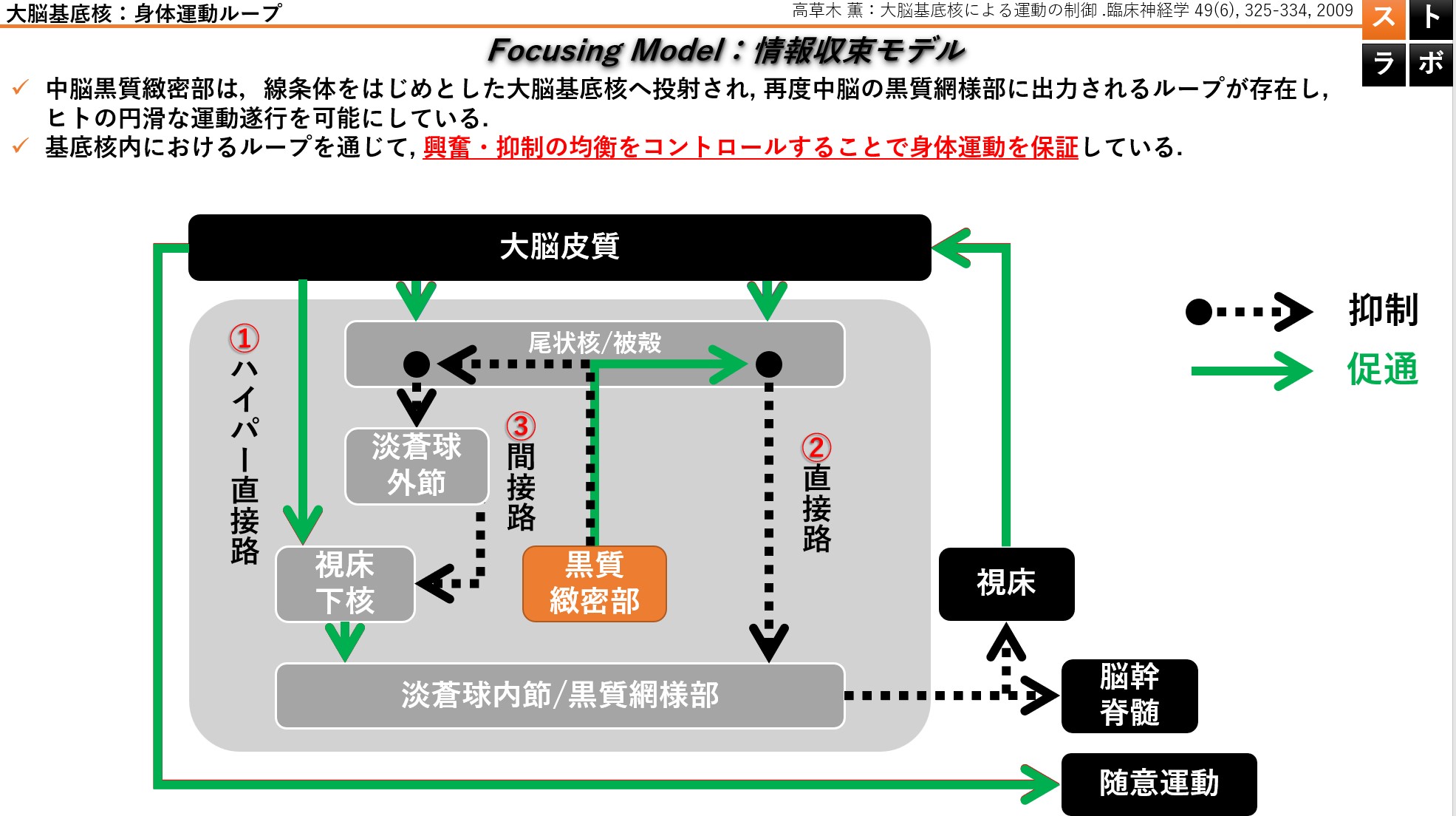
大脳基底核の構造を含むように重ね合わせたコロナルスライス。緑矢印と黒色ドット矢印はそれぞれ促通性、抑制性の経路であることを示しています。直接路では興奮性、間接路では抑制性の経路であることを示しています。
病態は?
大脳基底核は、特に運動障害と関連しています。大脳基底核の損傷は、振戦、不随意筋運動、異常緊張、運動開始の困難、異常姿勢に関連します。
運動障害にはさまざまな運動障害がありますが、そのすべてが大脳基底核の機能障害に関連しているわけではありません。
病理学的根拠が明確に確立され、大脳基底核が直接関与する病態生理学的機序によって引き起こされるものには、以下のものがあります。
●パーキンソン病
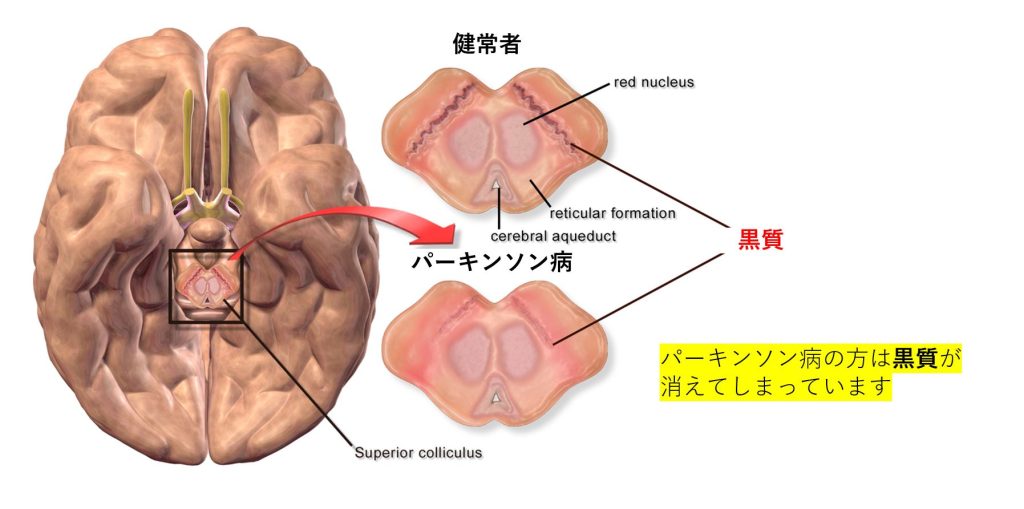
パーキンソン病は、大脳基底核の最も有名な疾患です。古典的な臨床症状として、動作緩慢、安静時振戦、姿勢不安定、小刻み歩行があります。この疾患は、視床下核のドパミン作動性ニューロンの神経変性の結果です。パーキンソン病の線条体では、αシヌクレインタンパク質の凝集体が、神経細胞内の封入体である毒性「レビー小体」を形成することがよく知られています。
黒質は、変性により目に見える黒い色素を失いますが、これはドーパミンの生合成の機能障害に付随する徴候です。このドーパミンの損失は、黒質経路を抑制します。ドーパミン入力の減少に伴い、線条体は促通性を低下させ、負の運動抑制を増加させます。これは、これらの患者に見られる特徴的な運動低下に伴う機能障害をもたらします。
●ハンチントン病
ハンチントン病は運動過多の運動障害です。その原因は、染色体4p上のHTT遺伝子のCAG繰り返しとして現れる遺伝的欠陥です。このため、ハンチントン遺伝子が異常に長くなり、尾状核と被殻の神経細胞死が起こります。間接的な経路が遮断され、運動過多の症状を呈します。症状としては、コリアなどの不随意運動、認知機能の低下、精神機能障害などがあります。
●ヘミバリズム
ヘミバリズム(ギリシャ語の「投げる」から)は、同側の腕および脚の運動過多、不随意、力強い運動を表すのに用いられます。一般に、対側の視床下核の病変はヘミバリズムを引き起こします。視床下核は間接経路の一部であるため、この病変は間接経路のシグナルを減少または除去し、直接経路の活動が相対的に過剰になります。このような原因には、脳卒中、外傷性脳損傷、筋萎縮性側索硬化症、非ケトン性高血糖、新生物、血管奇形、およびその他の原因が含まれます。
●トゥレット症候群
トゥレット症候群は、「チック」と呼ばれる突然の反復的な制御不能な運動および発声として現れます。
これらのチックは、線条体からのGABA作動性投射の機能障害と関連しており、血球症やハンチントン病と同様にドーパミン作動性活性の相対的な上昇をもたらします。
さらに、大脳基底核の一部は、報酬と強化、習慣性行動および習慣形成に重要な役割を担っています。うつ病や強迫性障害などの精神疾患の病態生理には、大脳基底核と他の多くの構造(特に前頭前野と大脳辺縁系)との関連があります。 認知障害に関しては、統合失調症の患者において大脳基底核の異常が認められており、この障害に伴う学習障害を説明できるかもしれません。
2008年の研究では、健康な中年成人の約5%が大脳基底核に微小脳梗塞を有していることが明らかにされています。
リハビリテーションは?理学療法を中心に
運動の重要性と価値は、様々な健康状態においてますます明らかになりつつあります。ここでは、運動とBG機能に関する最新の知見をいくつかご紹介します。
認知パフォーマンスと大脳基底核の変化でBeckerらによる2016年の研究では、身体活動、特に運動体力レベルのトレーニングは、大脳基底核の構造変化をもたらす有用なツールかもしれないと結論付けています。
これは、高齢者の認知機能の低下を軽減し、子供や若者の学業成就をサポートする可能性があるかもしれません。
運動は有益であり、パーキンソン病の管理において処方されるべきです(機能を補助する可能性があります)。
大脳基底核の損傷に対する運動効果は?
成人の脳は、加齢やパーキンソン病を含む神経変性疾患の状況下でも、経験に依存した神経可塑性の驚異的な能力を有しており、神経栄養因子の活性化が重要な役割を果たすと考えられます。
ドーパミン枯渇の動物モデルでは、運動が神経細胞のシナプス結合、特に大脳基底核内のドーパミン神経伝達とグルタミン酸神経伝達の変化を通じて脳を再編成できる基本的なメカニズムが明らかになりつつあります。
パーキンソン病の進行を抑える運動療法の詳細は↓↓↓
疫学研究、臨床観察、動物実験から、適切に投与された身体活動や運動は、脆弱な集団におけるパーキンソン病発症リスクを低減するだけでなく、潜在的に残存する黒質ドーパミンニューロンを保護したり、機能不全の大脳皮質-基底核の運動制御回路を直接回復させます。
パーキンソン患者に利益をもたらし、これらの利益は神経栄養因子などの内因性神経保護分子の運動トリガーによる生産によって媒介されているかもしれないことが示されています。
動物実験は、パーキンソン病で深刻な影響を受けている皮質・三叉神経回路の運動誘発性神経可塑性の証拠を提供するのに役立っています。
運動は、ドーパミンとグルタミン酸の神経伝達を調節し、シナプス形成を変化させ、脳血流を増加させることが示唆されています。
さらに、最近の研究では、運動の種類によって、脳回路に局所的な影響がある可能性があります。また、熟練した運動は、純粋な有酸素運動よりも前頭葉-線条体関連の回路に大きな影響を与えることが示唆されています。つまり、熟練した運動は前頭葉関連の回路にも大きな影響を与えることがわかっています。
これらの効果は相互に排他的なものではありません。例えば、自転車を漕ぐことは、主に有酸素運動であり、スキルや認知的関与はほとんどないと考えられます。一方、ジャグリングは高度なスキルを要するタスクであり、有酸素運動への関与はほとんどないと考えられます。
しかし、水泳やランニングのような多くの運動は、熟練した運動と有酸素運動の両方を含んでいます。
記事は→こちら
参考文献
1 Lanciego . Functional neuroanatomy of the basal ganglia. Cold Spring Harbor perspectives in medicine. 2012 Dec 1;2(12):a009621.
2 Kéri . Interactive memory systems and category learning in schizophrenia. Neuroscience & Biobehavioral Reviews. 2008 Jan 1;32(2):206-18.
3Hou L, Chen W et al , Exercise-induced neuroprotection of the nigrostriatal dopamine system in Parkinson’s disease. Frontiers in aging neuroscience. 2017 Nov 3;9:358.
4 Becker L, Kutz DF, Voelcker-Rehage C. Exercise-induced changes in basal ganglia volume and their relation to cognitive performance. Available https://www.jneurology.com/articles/exerciseinduced-changes-in-basal-ganglia-volume-and-their-relation-to-cognitive-performance.html

1981 :長崎市生まれ 2003 :国家資格取得後(作業療法士)、高知県の近森リハビリテーション病院 入職 2005 :順天堂大学医学部附属順天堂医院 入職 2015 :約10年間勤務した順天堂医院を退職 2015 :都内文京区に自費リハビリ施設 ニューロリハビリ研究所「STROKE LAB」設立 脳卒中/脳梗塞、パーキンソン病などの神経疾患の方々のリハビリをサポート 2017: YouTube 「STROKE LAB公式チャンネル」「脳リハ.com」開設 2022~:株式会社STROKE LAB代表取締役に就任 【著書,翻訳書】 近代ボバース概念:ガイアブックス (2011) エビデンスに基づく脳卒中後の上肢と手のリハビリテーション:ガイアブックス (2014) エビデンスに基づく高齢者の作業療法:ガイアブックス (2014) 新 近代ボバース概念:ガイアブックス (2017) 脳卒中の動作分析:医学書院 (2018) 脳卒中の機能回復:医学書院 (2023) 脳の機能解剖とリハビリテーション:医学書院 (2024) パーキンソン病の機能促進:医学書院 (2025)